Cientistas descobrem o “gene do caos” que faz o câncer evoluir de forma mortal
15 dezembro 2025 às 13h14
COMPARTILHAR
Durante décadas, pesquisadores observaram que alguns tipos de câncer simplesmente não seguem o curso “tradicional” de evolução biológica. Em vez de acumular mutações de forma gradual, esses tumores parecem dar saltos abruptos, mudando rapidamente, adaptando-se ao ambiente e escapando dos tratamentos disponíveis. Agora, um estudo liderado por cientistas da Universidade da Califórnia, em San Diego, trouxe a resposta.
No centro da descoberta está a cromotripsia, um fenômeno extremo no qual um cromossomo inteiro se fragmenta em dezenas, ou até centenas, de pedaços e, em seguida, é remontado de maneira caótica dentro da célula. O resultado desse processo é um verdadeiro colapso genético, que favorece o crescimento acelerado do câncer e amplia sua capacidade de resistir às terapias.
Embora a cromotripsia tenha sido descrita há mais de uma década, a ciência ainda não compreendia exatamente como ela se iniciava. O novo trabalho, porém, aponta um responsável direto por acionar esse “efeito dominó” molecular.
Em condições normais, alterações no DNA ocorrem de forma lenta e progressiva, acompanhando o ciclo natural das células. Na cromotripsia, entretanto, tudo acontece de uma só vez. É como se um livro inteiro fosse rasgado em inúmeras páginas e depois reencadernado fora de ordem, alterando completamente o sentido da história.
Embora rara em células saudáveis, essa ocorrência é surpreendentemente comum em tumores. Estimativas indicam que cerca de um em cada quatro cânceres apresenta sinais desse tipo de fragmentação extrema. Em doenças particularmente agressivas, como o osteossarcoma, praticamente todos os casos analisados carregam marcas da cromotripsia.
Essa avalanche de alterações genéticas oferece uma vantagem evolutiva às células cancerígenas. Ao concentrar tantas mudanças em um único evento, o tumor ganha rapidamente novas características, incluindo a capacidade de driblar medicamentos e continuar se multiplicando mesmo diante de tratamentos agressivos.
Ainda assim, apesar da relevância clínica do fenômeno, os cientistas esbarravam em uma pergunta: o que, exatamente, dá início à destruição súbita de um cromossomo inteiro?
O ponto de partida desse processo parece estar ligado a falhas na divisão celular. Em uma divisão saudável, os cromossomos permanecem organizados e protegidos dentro do núcleo da célula. Quando algo dá errado, porém, um cromossomo pode ficar isolado do restante do material genético e acabar aprisionado em uma estrutura muito menor e mais frágil, conhecida como micronúcleo.
Essa espécie de “bolha improvisada” oferece pouca proteção. Se ela se rompe, o cromossomo fica completamente exposto, vulnerável a danos, como um fio elétrico sem isolamento.
Até recentemente, ninguém sabia o que acontecia depois dessa exposição. A grande incógnita era identificar quem, ou o quê, aproveitava essa fragilidade para iniciar a fragmentação do DNA. Foi justamente essa lacuna que os pesquisadores decidiram investigar.
Para isso, eles analisaram, em tempo real, todas as nucleases humanas conhecidas, enzimas capazes de cortar o DNA, observando seu comportamento dentro de células cancerígenas.
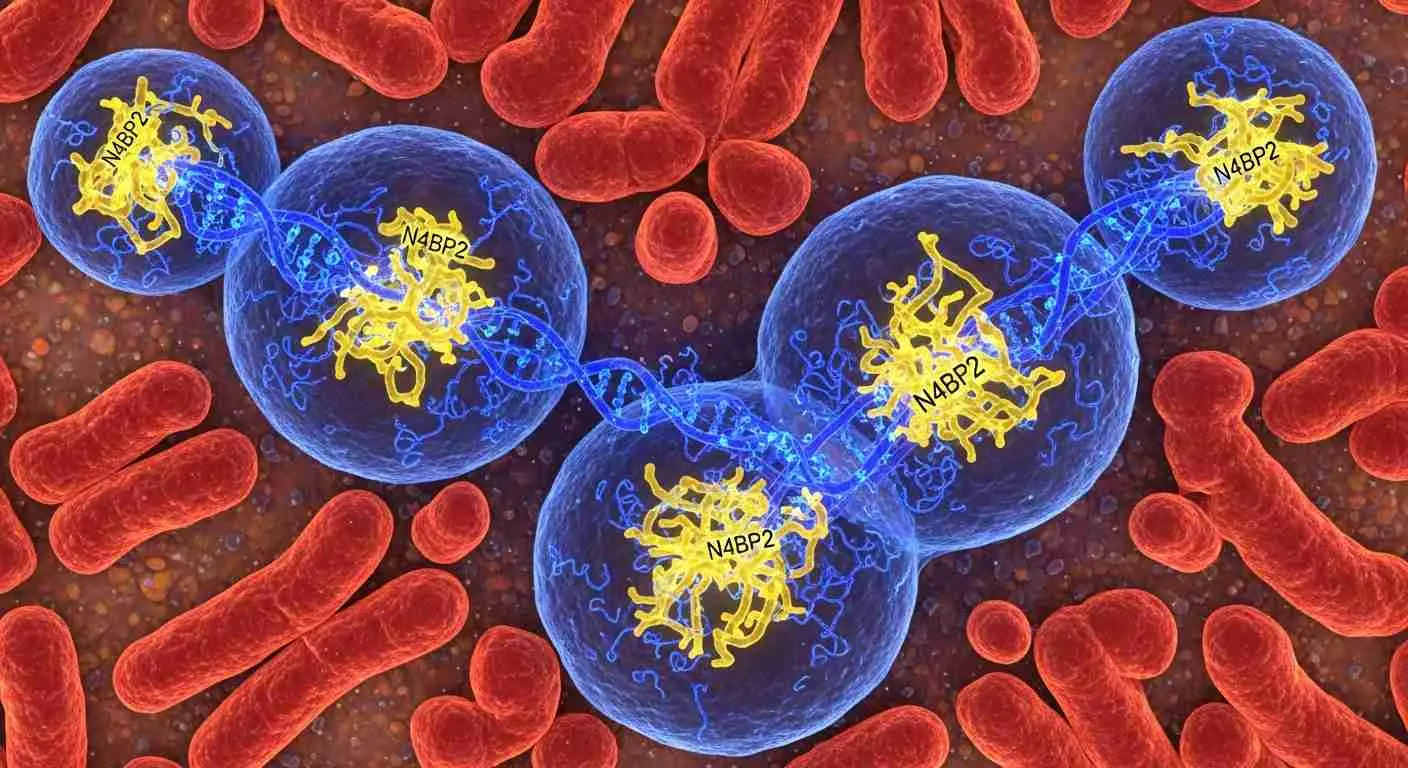
O resultado foi surpreendente. Entre todas as enzimas avaliadas, apenas uma demonstrou capacidade de entrar nos micronúcleos e provocar danos extensos ao material genético: a N4BP2. Mais do que uma simples associação, os experimentos mostraram que essa enzima é suficiente para desencadear o processo.
Quando os cientistas removeram a N4BP2 de células de câncer cerebral, a fragmentação cromossômica caiu drasticamente. Em sentido oposto, ao forçar a presença da enzima no núcleo de células saudáveis, cromossomos intactos começaram a se quebrar.
Essas evidências indicam que a N4BP2 não é apenas uma participante secundária, mas o verdadeiro gatilho da cromotripsia. A descoberta ganha ainda mais relevância quando os pesquisadores ampliam a análise para um banco de dados com mais de 10 mil genomas de diferentes tipos de câncer.
O padrão se repete de forma consistente: tumores que produzem grandes quantidades dessa enzima são justamente aqueles com mais sinais de cromossomos quebrados e rearranjados de maneira caótica.
Além disso, esses mesmos tumores apresentam níveis elevados de DNA extracromossômico, conhecido como ecDNA. Diferentemente do DNA organizado em cromossomos, o ecDNA circula em pequenos anéis soltos dentro da célula e costuma carregar genes que aceleram o crescimento tumoral. Por essa razão, ele está fortemente associado a cânceres mais agressivos e difíceis de tratar, já que facilita a adaptação do tumor aos medicamentos.
Até agora, o ecDNA era tratado quase como um fenômeno independente. O novo estudo, porém, sugere uma ligação direta entre os dois processos. Quando um cromossomo se fragmenta de forma desordenada durante a cromotripsia, alguns desses pedaços passam a circular livremente dentro da célula, dando origem ao DNA extracromossômico. Assim, o caos inicial desencadeado pela N4BP2 pode estar alimentando, em cadeia, mecanismos que tornam o câncer ainda mais resistente.
Ao identificar a enzima responsável por iniciar essa sequência de eventos, a pesquisa abre uma nova frente promissora no combate aos tumores mais difíceis. A proposta não é, necessariamente, eliminar o câncer de imediato, mas frear sua capacidade de evoluir, se adaptar e retornar após o tratamento. Bloquear a N4BP2, ou as vias moleculares que permitem sua atuação, pode significar reduzir o ritmo do desastre genético que impulsiona a agressividade tumoral.
Leia também:
Presidente da CCJ do Senado afirma que PL da Dosimetria é “pró-facção” e “absurdo”